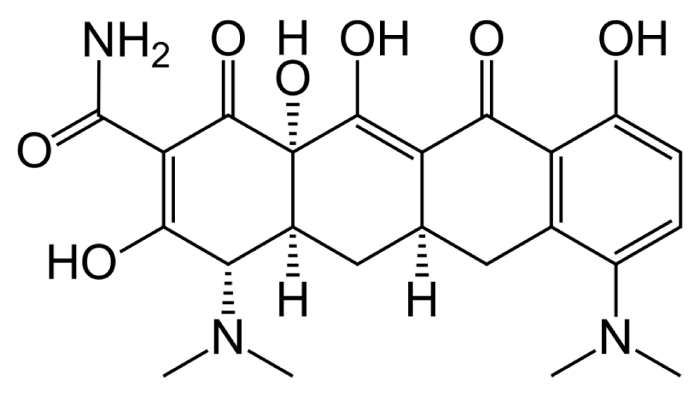
O potencial do 101-PGC-005 para revolucionar o tratamento da AIJS é explorado
A PIF Partners anunciou que seu medicamento experimental patenteado, 101-PGC-005 (€˜005), recebeu a designação de doença pediátrica rara (RPDD) da Food and Drug Administration (FDA) dos EUA para o tratamento de surtos de artrite idiopática juvenil sistêmica (AIJS). €˜005 é um pró-fármaco Tipo IA de dexametasona que tem como alvo macrófagos CD206+, e está atualmente passando por ensaios clínicos de Fase 3 em nove centros na Índia para o tratamento de SDRA induzida por COVID-19, conforme registrado sob CTRI/2024/01/061531. Alec Goldberg, CEO da PIF Partners, expressou seu entusiasmo sobre o reconhecimento do €˜005 pela FDA, enfatizando seu potencial para atender às necessidades médicas significativas não atendidas de crianças que sofrem de sJIA. Ele destacou ainda que a designação representa um marco crítico para a empresa, que continua comprometida em desenvolver terapias inovadoras para doenças inflamatórias pediátricas raras. Goldberg observou que, ao atingir macrófagos ativados com compostos anti-inflamatórios potentes, o €˜005 visa aumentar a eficácia ao mesmo tempo em que minimiza a toxicidade. É importante ressaltar que o composto não demonstrou supressão do eixo hipotálamo-hipófise-adrenal (HPA), o que sugere que ele suplementa, em vez de substituir, a resposta anti-inflamatória natural do corpo. O RPDD é uma designação concedida pelo FDA para incentivar o desenvolvimento de novos medicamentos ou produtos biológicos que tratem de condições graves ou fatais que afetam principalmente crianças menores de 18 anos e com menos de 200.000 indivíduos afetados nos EUA. Essa designação também torna os Parceiros PIF elegíveis para um Voucher de Revisão Prioritária (PRV) mediante a aprovação eventual de €˜005. O PRV pode agilizar o processo de revisão para uma futura aplicação de marketing, encurtando o período típico de revisão de 10 meses para apenas seis meses.
Comentário da colunista da SuppBase Alice Winters
 O anúncio recente da PIF Partners marca um passo significativo no desenvolvimento do 101-PGC-005 (€˜005) como um tratamento potencial para crises de artrite idiopática juvenil sistêmica (sJIA). Esta terapia é projetada para atingir macrófagos CD206+, um componente crucial em doenças inflamatórias. Ao alavancar a dexametasona em sua forma de pró-fármaco, o €˜005 é posicionado como um poderoso agente anti-inflamatório, visando a inflamação em um nível celular, mantendo o foco na minimização dos efeitos adversos tipicamente associados a tratamentos baseados em esteroides. A Rare Pediatric Disease Designation (RPDD) concedida pelo FDA é notável não apenas por sua raridade, mas também porque ressalta a importância de visar doenças pediátricas que não são atendidas pelas terapias existentes. A AIJS é uma condição crônica e debilitante em crianças, e encontrar tratamentos eficazes que possam aliviar os sintomas e reduzir as complicações de longo prazo continua sendo um desafio substancial. A designação destaca a gravidade dessa necessidade não atendida e posiciona o €˜005 como uma opção terapêutica promissora. Um dos aspectos mais atraentes dessa terapia, conforme apontado pelo CEO Alec Goldberg, é seu direcionamento de macrófagos ativados usando dexametasona, um potente corticosteroide. No entanto, diferentemente dos esteroides tradicionais que podem suprimir a resposta anti-inflamatória natural do corpo afetando o eixo HPA, o €˜005 foi projetado para suplementar os mecanismos inatos do corpo. Essa distinção é crítica porque os tratamentos com corticosteroides são frequentemente associados a vários efeitos colaterais, incluindo desequilíbrios hormonais, supressão imunológica e problemas de crescimento, particularmente em pacientes pediátricos. A alegação de nenhuma supressão do eixo HPA é particularmente significativa, pois pode implicar que o €˜005 oferece uma abordagem inovadora para tratar doenças inflamatórias com efeitos colaterais sistêmicos reduzidos. Ainda assim, mais dados clínicos serão necessários para validar essa alegação em aplicações do mundo real. O compromisso da empresa em explorar outras doenças órfãs caracterizadas por inflamação sistêmica sugere uma visão mais ampla além da sJIA. Se for comprovado como eficaz, o €˜005 pode se tornar um tratamento fundamental não apenas para a sJIA, mas também para outros distúrbios inflamatórios pediátricos, alterando potencialmente o cenário do tratamento para essas condições raras. O sucesso inicial nos ensaios de Fase 3 para SDRA induzida pela COVID-19, embora fora do escopo de seu alvo primário, reflete o potencial terapêutico do €˜005 no gerenciamento de respostas inflamatórias em diversos contextos. Embora a base científica da terapia seja promissora, é essencial considerar vários fatores à medida que o processo de desenvolvimento continua. Primeiro, os ensaios clínicos na Índia ainda estão em andamento, e a eficácia e a segurança a longo prazo do medicamento, especialmente em populações pediátricas, ainda precisam ser totalmente compreendidas. Além disso, o impacto do Voucher de Revisão Prioritária (PRV) não deve ser exagerado. Embora possa agilizar o processo de revisão do FDA para solicitações de marketing subsequentes, o valor real do PRV dependerá, em última análise, do desempenho do €˜005 em ensaios clínicos e de sua capacidade de atender aos rigorosos padrões de aprovação definidos pelos órgãos reguladores. De uma perspectiva de mercado, a aprovação do €˜005 pode abrir portas não apenas para novas vias de tratamento em doenças pediátricas raras, mas também para os Parceiros PIF, que podem se beneficiar de maior visibilidade no mercado de medicamentos órfãos. Este segmento da indústria farmacêutica está crescendo, com investimentos significativos sendo investidos em terapias que abordam necessidades não atendidas em doenças raras. Como tal, a estratégia da PIF Partners se alinha bem com as tendências atuais do mercado, embora precise garantir que navegue cuidadosamente no cenário competitivo de tratamentos para doenças raras. Concluindo, o 101-PGC-005 representa um avanço intrigante no tratamento da artrite idiopática juvenil sistêmica artrite e potencialmente outros distúrbios inflamatórios. Embora os dados clínicos em estágio inicial e a abordagem inovadora para reduzir os efeitos colaterais relacionados aos esteroides sejam promissores, o verdadeiro impacto do €˜005 dependerá da conclusão dos testes em andamento, da validação clínica mais ampla e da eventual comercialização do medicamento. Por enquanto, a designação RPDD da FDA sinaliza um futuro promissor tanto para o produto quanto para seus desenvolvedores.
O anúncio recente da PIF Partners marca um passo significativo no desenvolvimento do 101-PGC-005 (€˜005) como um tratamento potencial para crises de artrite idiopática juvenil sistêmica (sJIA). Esta terapia é projetada para atingir macrófagos CD206+, um componente crucial em doenças inflamatórias. Ao alavancar a dexametasona em sua forma de pró-fármaco, o €˜005 é posicionado como um poderoso agente anti-inflamatório, visando a inflamação em um nível celular, mantendo o foco na minimização dos efeitos adversos tipicamente associados a tratamentos baseados em esteroides. A Rare Pediatric Disease Designation (RPDD) concedida pelo FDA é notável não apenas por sua raridade, mas também porque ressalta a importância de visar doenças pediátricas que não são atendidas pelas terapias existentes. A AIJS é uma condição crônica e debilitante em crianças, e encontrar tratamentos eficazes que possam aliviar os sintomas e reduzir as complicações de longo prazo continua sendo um desafio substancial. A designação destaca a gravidade dessa necessidade não atendida e posiciona o €˜005 como uma opção terapêutica promissora. Um dos aspectos mais atraentes dessa terapia, conforme apontado pelo CEO Alec Goldberg, é seu direcionamento de macrófagos ativados usando dexametasona, um potente corticosteroide. No entanto, diferentemente dos esteroides tradicionais que podem suprimir a resposta anti-inflamatória natural do corpo afetando o eixo HPA, o €˜005 foi projetado para suplementar os mecanismos inatos do corpo. Essa distinção é crítica porque os tratamentos com corticosteroides são frequentemente associados a vários efeitos colaterais, incluindo desequilíbrios hormonais, supressão imunológica e problemas de crescimento, particularmente em pacientes pediátricos. A alegação de nenhuma supressão do eixo HPA é particularmente significativa, pois pode implicar que o €˜005 oferece uma abordagem inovadora para tratar doenças inflamatórias com efeitos colaterais sistêmicos reduzidos. Ainda assim, mais dados clínicos serão necessários para validar essa alegação em aplicações do mundo real. O compromisso da empresa em explorar outras doenças órfãs caracterizadas por inflamação sistêmica sugere uma visão mais ampla além da sJIA. Se for comprovado como eficaz, o €˜005 pode se tornar um tratamento fundamental não apenas para a sJIA, mas também para outros distúrbios inflamatórios pediátricos, alterando potencialmente o cenário do tratamento para essas condições raras. O sucesso inicial nos ensaios de Fase 3 para SDRA induzida pela COVID-19, embora fora do escopo de seu alvo primário, reflete o potencial terapêutico do €˜005 no gerenciamento de respostas inflamatórias em diversos contextos. Embora a base científica da terapia seja promissora, é essencial considerar vários fatores à medida que o processo de desenvolvimento continua. Primeiro, os ensaios clínicos na Índia ainda estão em andamento, e a eficácia e a segurança a longo prazo do medicamento, especialmente em populações pediátricas, ainda precisam ser totalmente compreendidas. Além disso, o impacto do Voucher de Revisão Prioritária (PRV) não deve ser exagerado. Embora possa agilizar o processo de revisão do FDA para solicitações de marketing subsequentes, o valor real do PRV dependerá, em última análise, do desempenho do €˜005 em ensaios clínicos e de sua capacidade de atender aos rigorosos padrões de aprovação definidos pelos órgãos reguladores. De uma perspectiva de mercado, a aprovação do €˜005 pode abrir portas não apenas para novas vias de tratamento em doenças pediátricas raras, mas também para os Parceiros PIF, que podem se beneficiar de maior visibilidade no mercado de medicamentos órfãos. Este segmento da indústria farmacêutica está crescendo, com investimentos significativos sendo investidos em terapias que abordam necessidades não atendidas em doenças raras. Como tal, a estratégia da PIF Partners se alinha bem com as tendências atuais do mercado, embora precise garantir que navegue cuidadosamente no cenário competitivo de tratamentos para doenças raras. Concluindo, o 101-PGC-005 representa um avanço intrigante no tratamento da artrite idiopática juvenil sistêmica artrite e potencialmente outros distúrbios inflamatórios. Embora os dados clínicos em estágio inicial e a abordagem inovadora para reduzir os efeitos colaterais relacionados aos esteroides sejam promissores, o verdadeiro impacto do €˜005 dependerá da conclusão dos testes em andamento, da validação clínica mais ampla e da eventual comercialização do medicamento. Por enquanto, a designação RPDD da FDA sinaliza um futuro promissor tanto para o produto quanto para seus desenvolvedores.